製藥
迎接挑戰,確保藥物的品質和合規性
在受高度監管的製藥產業中,品質和安全是產業基本原則。創新、高效率和高品質的產品,須遵守 FDA 和各種藥典所規定的 21 CFR Part 11 要求框架。需要監控、檢查和反檢查各種參數。安東帕提供諸多解決方案,可用於品質、生產控制和研發,甚至可在現場驗證您新採購的儀器,並縮短將儀器整合至工作流程的時間。
Anton Paar 產品

Nova

Lyza 3000

Lyza 7000

RST

SAXSpoint 500

SAXSpoint 700

SAXSpace

MCR 53

MCR 73

MCR 93
PNR 500

Litesizer DLS 101

Litesizer DLS 301

Litesizer DLS 501

Litesizer DLS 701

DSR 502

Litesizer DIA 100

Litesizer DIA 500

Litesizer DIA 700

MCR 703 MultiDrive

SVM 2001

SVM 3001

SVM 3001 Cold Properties

SVM 4001

DMA 35 標準版

L-Dens 3300

L-Dens 7400

L-Dens 7500

PoreMaster

PoreMaster 33

PoreMaster 60

XRDynamic 500
濁度測量系統

聚合物測量系統

聚合物測量系統 配置 1

聚合物測量系統 配置 2

製藥測量系統

製藥測量系統 配置 1

製藥測量系統 配置 2

製藥測量系統 配置 3

NHT³

L-Com 5500
DMA 6002 Sound Velocity

Abbemat Advanced 5001

Abbemat Advanced 5101

Abbemat Advanced 5201

Julia DSC 300
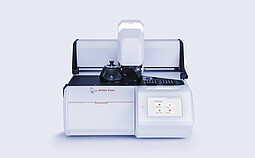
Julia DSC 500

MCT³

Monowave

Monowave 200

Monowave 400

Monowave 450

Multiwave
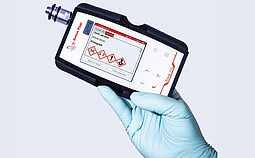
Cora 100

Snap 51

Ultratap 500

Ultratap 500 Twin
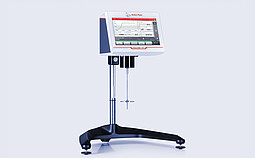
ViscoQC
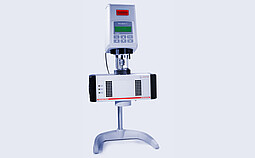
RheolabQC

Abbemat Essential 3001

Abbemat Essential 3101

Abbemat Essential 3201

MCP

DMA 4002
DMA 5002

DMA 6002

MCP 100

MCP 150

RapidOxy 100

RapidOxy 100 Fuel

MCR Rheometer + Cora 5001

L-Dens 2300

PMA 500

Ultrapyc

Ultrapyc 7000

Ultrapyc 7000 Micro

TRB V / THT V

L-Cor 8000

L-Cor 4000

DMA 1002

DMA 502

L-Rix

L-Sonic 5100

HTR 7000

ChemBET Pulsar
SVM 1001

SVM 1001 Simple Fill
SVM 1101 Simple Fill

Abbemat Pharma 7001

Abbemat Pharma 7201

UNHT³

MCR 703 MultiDrive

MCR 703 Space MultiDrive

TRB³

Cora 5001 Fiber 標準版

Cora 5001 Fiber 製藥版

Cora 5001 Fiber 過程監控

Cora 5001 Direct 標準版

Cora 5001 Direct 製藥版

Litesizer DIF 100

Litesizer DIF 300
Litesizer DIF 500

L-Cor 6000

Autosorb

Autosorb 6100

Autosorb 6200

Autosorb 6300
檢查小量藥物的純度和功效
在藥物開發和逆向工程中,通常只能處理小量樣本。當使用 MCP 系列 旋光儀測量旋光度或比旋光度時,可以使用 2.5 mm 長的試樣管解決這個問題。這些小試樣管也非常適合測量深色樣本。模組化系統 (如 Modulyzer ) 提供節省空間和樣本的解決方案,能在一個測量週期中從同一個樣本瓶測量旋光度和折射率。
加速產生藥物開發的資料庫
產生藥物開發的同步或依序合成化合物庫既耗時又昂貴。必須預先將反應參數最佳化,例如溫度、時間以及溶劑、添加劑、催化劑的變化或基質的莫耳比。此外,在藥物開發過程中所需的產品數量也會改變。與傳統加熱相比,採用微波輔助合成可以大幅縮短反應時間。例如,預期節省的資料庫生產時間,可從一般所需的 37 天減少至只要 2 天。使用安東帕配有自動樣本瓶處理系統的 Monowave 400 ,可以依序合成 24 種化合物庫。具有碳化矽板的 Multiwave PRO 可以對多達 192 個位置進行反應篩選。
檢查溶液的穩定性
如果眼藥水等溶液含有凝聚物,會使消費者感到不適。可以使用 Litesizer 粒度分析儀測量透射率,檢查凝聚的溶液。如果溶液的透射率低,則產品可能不符合市場的高標準要求。
儀器可以在 1 到 3 天內完成安裝、驗證並開始工作
除了需要遵守法規,也需要建立、整合新的測量儀器並為稽核做好準備。為選定的儀器實施安東帕的製藥認證方案,可讓您的新儀器在幾天內完成啟動並執行。認證方案涵蓋完整儀器認證的所有步驟 (DQ、IQ、OQ、PQ、風險分析、21 CFR Part 11 檢查清單、偏差列表、追蹤溯源表,和 Word 檔格式的使用者 SOP)。該方案符合 GMP、21 CFR Part 11、GAMP 5、USP <1058> 的要求,可用於後續的重新認證。
評估溫度和濕度引起的配方變化
藥物在生產過程和儲存期間,會暴露於濕度和溫度變化的環境。這些條件可能導致意外相變,使有效性產生變化,在最壞的情況下,可能產生負面影響。使用非環境 X 射線繞射,可以研究溫度和相對濕度對藥物晶體結構、相變和多形性的影響。利用安東帕的 CHC plus+ 低溫和潮濕箱,可以在高相對濕度和各種溫度下記錄 X 射線繞射資料。測量室可以遵循露點曲線,在恆定溫度下改變濕度,也可以在恆定濕度下改變溫度。