La fluidité, la solubilité, la consistance, la pureté et la stabilité sont des paramètres à prendre en compte lorsqu'il s'agit d'optimiser les poudres pharmaceutiques. Une large gamme d'instruments analytiques axés sur la caractérisation des poudres pharmaceutiques dans des conditions authentiques va vous aider à affiner l'efficacité du produit.
Un approfondissement de votre compréhension des propriétés des particules conduit à des formulations plus prévisibles. Comprenez le comportement d'écoulement de vos poudres à chaque étape - de la formulation à la production. Empêchez les conditions environnementales inconsidérées d'affecter l'efficacité et la qualité de la production.
Obtenez des résultats fiables et reproductibles pour des paramètres tels que l'aire de surface, la taille et la distribution des particules, la densité apparente et taraudée, les propriétés d'écoulement de la poudre, et plus encore. Obtenez des informations sur les propriétés des polymorphes à des températures non ambiantes grâce à la diffraction des rayons X. Identifiez les ingrédients pharmaceutiques actifs et les excipients avec la spectroscopie Raman. Préparez vos échantillons pour la spectrométrie de masse à plasma à couplage inductif via une digestion en vase clos.
Téléchargez le livre électronique, "Le guide pratique pour la caractérisation des poudres pharmaceutiques", et découvrez-en plus.

Le livre électronique d'Anton Paar à lire absolument : "Le guide pratique pour la caractérisation des poudres pharmaceutiques"
Approfondissez votre compréhension des matériaux et exercez un contrôle sur les poudres pharmaceutiques. Ce livre électronique, axé sur la caractérisation des poudres pharmaceutiques et contenant des données de mesure réelles, vous explique comment relever les défis des poudres pharmaceutiques tels que la fluidité, la solubilité et la consistance dans des conditions réelles.
Solubilité, vitesse de dissolution et consistance

L'optimisation de la cohérence de la formulation des médicaments, des taux de dissolution, de la biodisponibilité et de l'éventuel comportement d'absorption est essentielle au cours du développement, des essais et de l'administration des médicaments. L'une des principales propriétés physiques qui affecte directement chacun de ces paramètres est la taille des particules de la formulation. La mesure rapide et précise de la taille des particules et la distribution granulométrique d'une formulation de médicament et la façon dont elle évolue dans le temps et dans différentes conditions est souvent la première étape du développement d'une nouvelle formulation.
En outre, la surface et la porosité d'une formulation pharmaceutique en poudre fournissent encore plus d'informations, notamment sur la solubilité et les taux de dissolution. Plus précisément : plus la surface globale et le nombre de pores présents dans une poudre sont élevés, meilleures sont la solubilité et la vitesse de dissolution. La mesure précise de la taille des particules ainsi que de la surface et de la porosité des poudres pharmaceutiques est essentielle pour optimiser la consistance et l'administration des médicaments. Elle est également importante pour contrôler le taux de libération du médicament chez le patient.
Écoulement des poudres

Le traitement, la manipulation et le stockage des poudres à l'échelle industrielle posent des problèmes qui ne se posent généralement pas à l'échelle pilote. De nombreuses poudres présentent une dépendance comportementale significative aux conditions environnementales auxquelles elles sont soumises (par exemple, la température et l'humidité). Ces changements de comportement s'expriment par des modifications des propriétés telles que la fluidité, la cohésion, la tendance à l'agglomération - et bien d'autres encore. Ces effets généralement indésirables peuvent être problématiques lorsque, par exemple, l'excipient et les ingrédients pharmaceutiques actifs se séparent ou s'isolent. Cette modification des propriétés d'écoulement peut poser un problème lors du traitement et du remplissage.
La détermination des propriétés rhéologiques des poudres en fonction de la température/humidité permet de caractériser l'écoulement et le comportement mécanique des poudres pharmaceutiques. Analysez vos formulations de poudre et assurez-vous de définir les bonnes conditions de préparation. Comprenez les propriétés d'écoulement avec la rhéologie des poudres pour un transport, un traitement et un mélange efficaces et irréprochables.
Emballage et mise en table
La densité solide est une propriété importante des poudres pharmaceutiques - médicaments ou excipients. La densité apparente et la densité taraudée sont liées aux propriétés d'écoulement de la poudre. La fluidité d'une poudre, en particulier d'un additif ou d'un excipient, est importante pour déterminer comment cet additif affectera le processus de granulation ou de compression. Une bonne fluidité garantit un remplissage approprié et uniforme des capsules, ce qui permet d'obtenir un poids et un dosage constants.
La détermination de la porosité ouverte d'un comprimé est essentielle pour comprendre de nombreuses propriétés différentes des comprimés, notamment leur résistance et leur durée de conservation. La porosité est également importante pour empêcher la fracture de l'excipient pendant la compression du comprimé.
Les mesures de pycnométrie gazeuse fournissent des données de densité squelettique qui vous permettent d'évaluer les informations sur l'écoulement de la poudre et la porosité des comprimés.
Pureté, stabilité et pourcentage de cristallinité (XRD et SAXS)

La stabilité à long terme des poudres pharmaceutiques et la manière dont, par exemple, les conditions de stockage et l'emballage affectent la stabilité de ces poudres sont d'un intérêt capital. Des méthodes telles que la diffraction des rayons X (XRD) et la diffusion des rayons X aux petits angles (SAXS) peuvent être utilisées pour analyser les poudres afin de détecter les effets du vieillissement qui altèrent le degré de cristallinité (le rapport entre les parties amorphes et les phases cristallines) ou créent d'autres changements structurels. Celles-ci vont considérablement changer avec le temps et avec les conditions de stockage des poudres. SAXS et XRD sont capables de mesurer des échantillons dans des conditions ambiantes et non ambiantes (et in situ, le cas échéant), ce qui donne des indications essentielles sur le vieillissement, la stabilité, le conditionnement approprié et les conditions de stockage optimales.
La structure cristalline de tout ingrédient pharmaceutique actif (IPA) détermine la stabilité, la solubilité et, finalement, la biodisponibilité du produit. La XRD est la méthode standard d'identification des phases cristallines et de criblage des polymorphes des IPA pour comprendre les formes présentes dans une poudre.
Préparation d’échantillons pour l’Analyse Élémentaire de Pureté

Étant donné que les impuretés élémentaires constituent non seulement un risque toxicologique pour le patient mais peuvent également affecter la qualité et l'efficacité des produits pharmaceutiques, leur analyse joue un rôle important dans le développement et le contrôle de la qualité des produits pharmaceutiques.
La quantification des impuretés élémentaires est réalisée au moyen de l'ICP-OES ou de l'ICP MS, ainsi que de techniques de préparation d'échantillons fiables comme la digestion acide assistée par micro-ondes. L'utilisation de cette méthode particulière de préparation des échantillons garantit d'excellents taux de récupération, de faibles variations et un débit d'échantillons élevé.
Identification des échantillons
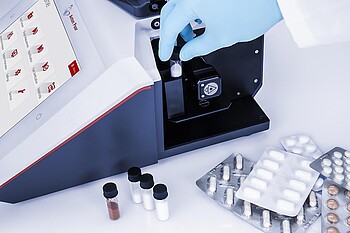
L'industrie de la production pharmaceutique est l'un des marchés mondiaux les plus fortement réglementés. Cela garantit la qualité des produits et minimise les risques pour les patients du monde entier. Les tests d'identité sont exigés par les pharmacopées internationales et les directives BPF pour tous les IPA, excipients, produits pharmaceutiques et matériaux d'emballage. Selon les chapitres 197 et 858 de l'US Pharmacopeia, les tests d'identité peuvent être réalisés à l'aide de la spectroscopie Raman et doivent être validés conformément à l'USP 1225.
Des méthodes rapides et précises sont nécessaires pour évaluer rapidement si un lot peut être utilisé ou doit être rejeté. Les solutions de contrôle d'identité doivent être conformes à la norme CFR 21 Part 11 de la FDA, et l'intégrité des données et une piste d'audit complète doivent être garanties.